Vamos relembrar um pouco sobre a solubilidade dos compostos orgânicos? Lembra da frase “semelhante dissolve semelhante”? Nós, do Blog do Enem, preparamos um resumo maneiro para você mandar ver nas questões do Enem e dos vestibulares de todo Brasil. Não fique de fora dessa!
Começando pelo começo, vamos relembrar o que é solubilidade: É a quantidade máxima de soluto que se dissolve em determinada quantidade de solvente a uma dada temperatura. Complicou? Sem problemas, vamos descomplicar. Acompanhe.
Agora vamos retornar a esse conceito dando mais destaque às substâncias orgânicas: A solubilidade de um sólido em um líquido ou miscibilidade entre os líquidos depende principalmente das forças intermoleculares existentes, daí a afirmação de que: substâncias polares se dissolvem em líquidos polares; substâncias apolares se dissolvem em líquidos apolares.
Ou como você já deve ter ouvido falar: “SEMELHANTE DISSOLVE SEMELHANTE”. A principal força intermolecular que atua entre as moléculas apolares é a do tipo dipolo induzido – dipolo induzido. 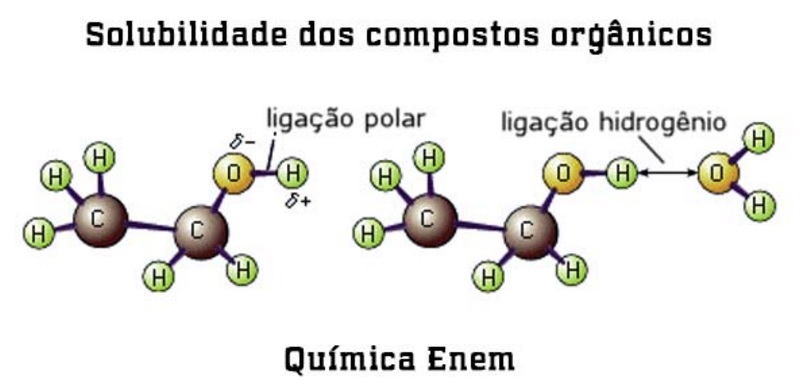
Compostos Orgânicos Solúveis:
Assim, como boa parte dos compostos orgânicos tem baixa polaridade, eles são solúveis em solventes apolares ou mesmo nos solventes pouco polares. Hidrocarbonetos, éteres, cetonas, e haletos orgânicos são exemplos de função orgânica cujos compostos constituem solventes muito utilizados para solubilizar substâncias orgânicas de baixa polaridade.
O iodo (I2) e tetracloreto de carbono (CCl4), são miscíveis por serem, ambos, apolares.  Veja na imagem um tubo de ensaio acima uma mistura de água (fase superior do tubo de ensaio) e tetracloreto de carbono.
Veja na imagem um tubo de ensaio acima uma mistura de água (fase superior do tubo de ensaio) e tetracloreto de carbono.
Substâncias Orgânicas (apolares) não se dissolvem na água: Como consequência, podemos verificar que a maioria das substâncias orgânicas (que são apolares) não se dissolve na água (que é um líquido polar). Um caso interessante a considerar é o dos álcoois. Os monoálcoois mais simples são totalmente miscíveis com água, como podemos observar na tabela abaixo.
Tabela de Solubilidade:

A solubilidade é devida, neste caso, as pontes de hidrogênio formadas entre as moléculas do álcool e da água.
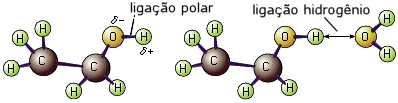
Pontes de hidrogênio entre a água e o etanol
Você observou que à medida que aumenta a cadeia carbônica, a miscibilidade em água diminui? Vamos ver porque isso acontece? – Para entender esse fato, vamos tomar como exemplo o etanol. Basta você lembrar que o álcool é formado por um grupo orgânico ( hidrofóbico) apolar, insolúvel em água e solúvel em solventes orgânicos, e pelo grupo OH (hidrofílico), altamente polar, solúvel em água.
Veja na imagem a Molécula de Etanol.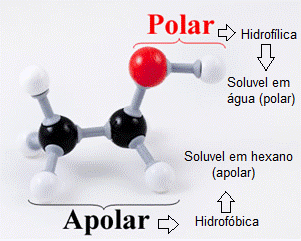
Assim, quanto maior o predomínio do grupo R, mais insolúvel em solventes polares o composto será, assim como, com o predomínio do grupo OH, maior será a solubilidade em solventes polares.
Curso Enem Gratuito
Aumente suas chances no próximo Enem com as aulas gratuitas do Curso Pré-Enem Online: aulas de todas as matérias que caem nas provas objetivas e também na Redação do Exame Nacional do Ensino Médio. Confira para mandar bem no Enem!

Aula Gratuita
Veja mais sobre a solubilidade dos compostos orgânicos, assistindo a vídeo aula da Khan Academy em Português e entenda tudo sobre esse assunto. Não deixe de conferir!
Exercícios sobre Solubilidade em Compostos Orgânicos
Você consegue resolver este exercício abaixo? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
(UERJ, 2016) Em um experimento, foi analisado o efeito do número de átomos de carbono sobre a solubilidade de alcoóis em água, bem como sobre a quiralidade das moléculas desses alcoóis. Todas as moléculas de alcoóis testadas tinham número de átomos de carbono variando de 2 a 5, e cadeias carbônicas abertas e não ramificadas.
Dentre os alcoóis utilizados contendo um centro quiral, aquele de maior solubilidade em água possui fórmula estrutural correspondente a:
a) 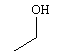
b) 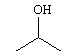
c) 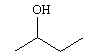
d) 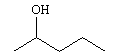
Resposta: C
(UERJ,2016) A temperatura e a pressão afetam a solubilidade do oxigênio no sangue dos organismos. Alguns animais marinhos sem pigmentos respiratórios realizam o transporte de oxigênio por meio da dissolução desse gás diretamente no plasma sanguíneo. Observe a variação da solubilidade do oxigênio no plasma, em função da temperatura e da profundidade a que o animal esteja submetido, representada nos gráficos abaixo.
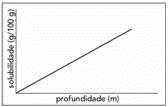
Um estudo realizado sob quatro diferentes condições experimentais, para avaliar a dissolução de oxigênio no plasma desses animais, apresentou os seguintes resultados:
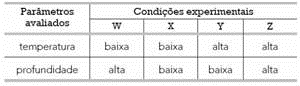
O transporte de oxigênio dissolvido no plasma sanguíneo foi mais favorecido na condição experimental representada pela seguinte letra:
a) W
b) X
c) Y
d) Z
Resposta : A
Dica 1– Plano de Estudos Gratuito de Química Enem e Vestibular > Veja o que mais cai em Química nas provas. Revisão dos 10 conteúdos mais frequentes, com aulas, dicas e simulados online nas quatro áreas principais: 1 – Química Geral, 2 – Físico-Química; 3 – Química Orgânica; e, 4 – Química Ambiental. Clique na imagem para acessar o Plano de Estudos de Quimica:
Dica – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.


