Revise sobre a classificação e a nomenclatura dos Óxidos em mais esta aula preparatória para as questões de Química no vestibular e no Enem. Aula gratuita com exercícios.
Óxidos são compostos químicos binários, onde um dos átomos é o oxigênio. Veja um resumo com o que você precisa recordar para o Enem ou o Vestibular.
A maioria dos elementos químicos formam óxidos. Por exemplo a ferrugem (Fe2O3(s)); o gás carbônico (CO2); e a cal (CaO). Ou seja, os óxidos estão no seu cotidiano sem que você perceba. E caem no Enem e no Vestibular.

Classificação e nomenclatura dos Óxidos:
Os óxidos estão divididos em 4 subgrupos: Óxidos Básicos, Óxidos Ácidos, Óxidos Neutros e Óxidos Anfóteros. Vamos começar a revisão pelos óxidos básicos.
Óxidos básicos
São óxidos onde o oxigênio está ligado a um metal de baixo número de oxidação (nox +1 e +2, exceto Pb, Zn, Sb e Sn, os quais formam óxidos anfóteros), principalmente metais alcalinos e alcalinos terrosos. Possuem estruturas iônicas. Os óxidos básicos reagem com água formando bases ou hidróxidos, e com ácidos formando sal e água (neutralização).
Exemplos:
Na2O + H2O → 2NaOH
K2O + H2O → 2KOH
CaO + H2O → Ca(OH)2
Na2O + 2HNO3 → 2NaNO3 + H2O
Nomenclatura de um óxido
Óxido de (nome do metal) – caso o metal apresente mais de um estado de oxidação, o nome do metal pode ser acompanhado dos sufixos OSO/ICO ou do número de oxidação do metal. xemplos:
Na2O – óxido de sódio
CuO – óxido cúprico ou óxido de cobre II
Cu2O – óxido cuproso ou óxido de cobre I
Óxidos ácidos ou anidridos
São óxidos onde o átomo de oxigênio está ligado a um ametal (não metal). Apresenta estrutura molecular. Pequena diferença de eletronegatividade entre o oxigênio e os ametais.
Ex. CO2; SO2; SO3.
São chamados de anidridos, pois são obtidos tam- bém da desidratação de ácidos inorgânicos. Exemplos:
H2SO4 quando perde uma molécula de água (H2O) resulta no SO3.
Os óxidos ácidos ou anidridos reagem com água formando ácidos oxigenados e com bases formando sal e água (neutralização). Veja os exemplos:
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
N2O3 + H2O → 2HNO2
CO2 + H2O → H2CO3
SO2 + 2KOH → K2SO3 + H2O

Nomenclatura para você recordar
CO2 – óxido de carbono IV ou dióxido de (mono)carbono ou anidrido carbônico.
SO2 – óxido de enxofre IV ou dióxido de (mono)enxofre ou anidrido sulfuroso.
SO3 – óxido de enxofre VI ou trióxido de (mono)enxofre ou anidrido sulfúrico.
Cl2O – óxido de cloro I ou monóxido de dicloro ou anidrido hipocloroso.
Cl2O7 – óxido de cloro VII ou heptóxido de dicloro ou anidrido perclórico.
SiO2 – óxido de silício ou dióxido de (mono) silício ou anidrido silícico.
Óxidos anfóteros
São óxidos de metais de transição e semimetais (metal com nox igual a +3 ou +4). Tais óxidos podem reagir como ácidos ou bases. Quanto maior a diferença de eletronegatividade entre o átomo de oxigênio e o outro elemento maior o caráter básico e vice-versa.
Ex.: Fe2O3; Al2O3; SnO; ZnO.
Os óxidos anfóteros reagem com ácidos ou bases formando sal e água. Veja os exemplos:
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2KOH → K2ZnO2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Nomenclatura
SnO – óxido de estanho II
SnO2 – óxido de estanho IV
Fe2O3 – óxido de ferro III
ZnO – óxido de zinco
Al2O3 – óxido de alumínio
Óxidos neutros
São óxidos denominados Neutros aqueles que não possuem caráter ácido e nem básicos. Não reagem com água.
Ex.:
CO – monóxido de carbono ou óxido de carbono II
NO – óxido de nitrogênio II
N2O – óxido de nitrogênio I ou óxido nitroso (gás do riso)
Óxidos duplos
São formados pela associação de dois óxidos do mesmo elemento (mesmo cátion), porém onde os números de oxidação dos átomos ligados ao átomo de oxigênio são diferentes. Veja os exemplos:
F3O4 – tetróxido de triferro (magnetita) – formando por óxidos de Fe II e Fe III
Pb3O4 – tetróxido de trichumbo (zarcão) – formado por óxido de Pb II e Pb III
Peróxidos
Os Peróxidos são óxidos formados por cátions das famílias 1A (metais alcalinos) e 2A (metais alcalinos-terrosos) e pelo oxigênio com nox -1. Confira nestes exemplos:
H2O2 – peróxido de hidrogênio ou água oxigenada (aplicado em cortes para combater bactérias anaeróbicas restritas (causadoras do tétano)).
Na2O2 – peróxido de sódio
Superóxidos
São associações de uma molécula de O2 (oxigênio atômico) com uma de O2-2 (peróxido), assim, o oxigênio tem nox igual a -1/2.
Os ânions superóxidos são altamente reativos e têm capacidade de cindir outras moléculas à medida que entram em contato. Espécies reativas de oxigênio como o superóxido são um dos responsáveis pelo envelhecimento celular bem como o desencadeamento de crescimentos celulares desordenados. Veja os exemplos:
NaO2 – superóxido de sódio
Duas vídeo-aulas gratuitas para você gravar o que precisa sobre Óxidos para o próximo Enem
Saiba mais sobre Óxidos nesta aula do Curso Enem Gratuito, disponíveis no Youtube. Após assistir, revise o que você aprendeu sobre óxidos respondendo aos nossos desafios!
Exercícios
Desafios sobre Óxidos para você resolver e compartilhar a solução
Questão 1
O alumínio é amplamente utilizado para fabricação de latas e utensílios domésticos. Este metal possui brilho, porém, em contato com o oxigênio forma óxido opaco (Al2O3 ).
O óxido de alumínio reage com ácidos e bases fortes da seguinte maneira.
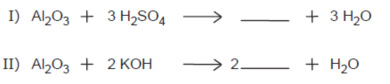
O Al2O3 é classificado como óxido _________, formando o composto ________ na reação I e _________ na reação II.
Assinale a alternativa que preenche corretamente as lacunas.
a) ácido – AlSO4 – KAlO4
b) básico – Al2(SO4)3 – KAlO3
c) anfótero – Al3(SO4)2 – KAlO4
d) básico – AlSO4 – KAlO4
e) anfótero – Al2(SO4)3 – KAlO2
Dica 1 – O Exame Nacional do Ensino Médio está chegando! Revise tudo sobre Bases: Definição de Arrhenius em mais esta aula de Química Enem – https://blogdoenem.com.br/bases-definicao-de-arrhenius-quimica-enem/
Questão 2
Para absorver a água eliminada na urina dos tripulantes de naves espaciais, a urina é reagida com óxido de lítio (Li2O). Nessa reação, forma-se:
a) Li(H2O)n
b) LiOH
c) Li(OH)2
d) Li(OH)3
e) Li(OH)4
Dica 2 – Revise sobre Funções inorgânicas em mais esta aula preparatória para a prova de Química Enem. Estude com a gente para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/funcoes-inorganicas-quimica-enem-2/
Questão 3
(Fuvest-SP)
Um médico atendeu um paciente com dores abdominais, originadas de uma patologia denominada “úlcera péptica duodenal”. Para o tratamento desse paciente, o médico prescreveu um medicamento que contém um hidróxido metálico, classificado como “uma base fraca”. Esse metal pertence, de acordo com a Tabela de Classificação Periódica, ao seguinte grupo:
a) 1A
b) 3A
c) 6A
d) 7A
e) zero ou 8A
Dica 3 – Relembre sobre os princípios da Estequiometria em mais esta aula de revisão para a prova de Química Enem. Pronto para o Exame Nacional do Ensino Médio? – https://blogdoenem.com.br/estequiometria-quimica-enem/
Questão 4
Uma forma genérica de se obterem ácidos é a reação entre seu anidrido (óxido ácido) e água. Entre os ácidos abaixo relacionados, não pode ser obtido por esse processo o:
a) ácido clorídrico
b) ácido hipocloroso
c) ácido cloroso
d) ácido clórico
e) ácido perclórico
Questão 5
Os calcários são rochas sedimentares que contêm minerais de carbonato de cálcio (aragonita ou calcita). Quando esses minerais são aquecidos a altas temperaturas (calcinação), ocorre a decomposição térmica do carbonato, com liberação de gás carbônico e formação de uma outra substância sólida. As fórmulas e as funções químicas dessas substâncias envolvidas são, respectivamente:
a) CaCO3 (óxido), CO2 (óxido) e CaO (base)
b) CaCO3 (sal), CO2 (óxido) e CaO (óxido)
c) CaC2O4 (sal), CO2 (óxido) e CaC2 (sal)
d) CaCO4 (sal), CO (óxido) e CaO (óxido)
e) CaCO2 (sal), CO2 (óxido) e CaO (sal)
Você consegue resolver estes exercícios sobre Óxidos? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!

