Você lembra-se de como os elétrons estão distribuídos no átomo? É hora de relembrar as camadas em que estão distribuídos os elétrons. Revise aqui com aulas da Khan Academy e as dicas da professora Munique Dias.
Não vacile. É hora de rever um conteúdo que cai muito nas provas dos vestibulares, do Enem e do Encceja: a distribuição dos elétrons ou Distribuição Eletrônica, cai direto, mas é um assunto que confunde muitos alunos na hora das provas. Veja como aprender e se dar bem no Enem.
A professora de Química Munique Dias, de Florianópolis, preparou uma super aula para você. Tem a teoria, os exemplos, vídeos da Khan Academy, e uma bateria de exercícios no padrão dos vestibulares e do Enem.
Tudo começa nas teorias dos modelos atômicos do filósofo Demócrito; depois, em 1803, com o inglês John Dalton; em seguida Joseph John Thomson em 1897; Arthur Rutherford entre 1908 e 1910; e mais recentemente o Modelo de Niels Bohr, chamado de Bohr-Ruthenberg, e datado de 1913.
Resumo Gratuito sobre as Camadas Eletrônicas
Confira com o professor Sobis, do canal do Curso Enem Gratuito, como é a Distribuição dos Elétrons em camadas.
Muito bom este resumo. O professor Sobis é mesmo show. Vamos continuar.
Se você não estiver em dia com as teorias dos Modelos Atômicos, faça aqui uma revisão da Estrutura do Átomo antes de prosseguir.  O cientista Niels Bohr propôs em 1913 que os elétrons estavam distribuídos em camadas definidas.
O cientista Niels Bohr propôs em 1913 que os elétrons estavam distribuídos em camadas definidas.
A eletrosfera atômica, portanto, era constituída por sete camadas eletrônicas, numeradas de um a sete, -1-2-3-4-5-6-7-, as quais também poderiam ser representadas pelas letras maiúsculas K,L,M,N,O,P e Q.
A camada 1 (ou K) era a camada mais próxima do núcleo e de menor energia, e a 7 (ou Q), a mais distante e de menor energia. Ou seja, as camadas não eram ‘apenas camadas’, mas reuniam características e propriedades próprias na eletrosfera.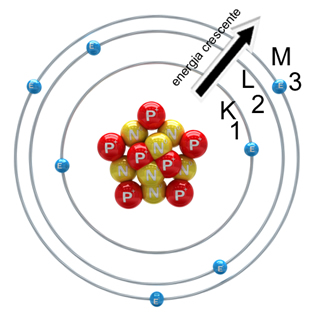 A forma como os elétrons estão distribuídos ao redor do núcleo, em camadas ou níveis de energia, é chamada de Distribuição eletrônica (veja na imagem acima).
A forma como os elétrons estão distribuídos ao redor do núcleo, em camadas ou níveis de energia, é chamada de Distribuição eletrônica (veja na imagem acima).
Você sabe fazer a distribuição dos elétrons na eletrosfera? Veja com a gente para chegar lá…
Para você fazer a distribuição dos elétrons nas camadas do átomo, você deve seguir algumas “regras”, não gosta de decorar regras? Nem a gente! Por isso o nosso blog preparou para você um breve roteiro, assim você nunca mais vai esquecer:
- – Conheça o número de elétrons; Como? Através do número atômico do elemento. Não lembra? Então assista a revisão sobre átomos no link: https://blogdoenem.com.br/quimica-atomo-khan-academy/.
- – Cada camada eletrônica ou nível de energia comporta um número máximo de elétrons, veja a tabela abaixo:
|
Camada eletrônica |
K |
L |
M |
N |
O |
P |
Q |
|
No máximo de elétrons |
2 |
8 |
18 |
32 |
32 |
18 |
8 |
Entendeu? Veja um exemplo:
Vamos fazer a distribuição eletrônica do potássio (K)?
Resolução: O número atômico do Potássio é 19. Como o potássio encontra-se no seu estado fundamental ou neutro, temos que o número atômico é igual ao número de elétrons.
Então distribuindo os elétrons nas camadas eletrônicas, e respeitando o número máximo de elétrons para cada camada temos que: 19K = K=2; L=8; M=8; N=1
Observação importante: A última camada eletrônica de um átomo comporta no máximo, oito elétrons. Assim, se a última camada contiver um número de elétrons superior a 8 e inferior a 18, deve-se deixar 8 nessa e passar para a próxima.
Aula Gratuita sobre Números Quânticos:
Uma camada de número n será subdividida em 4 subníveis, que são: s, p, d, f. E cada um desses subníveis possui um número máximo de elétrons, veja na tabela abaixo:
|
Subníveis |
s |
p |
d |
f |
|
No máximo de elétrons |
2 |
6 |
10 |
14 |
Vamos lembrar como é feita a distribuição dos elétrons nos subníveis (configuração eletrônica)?
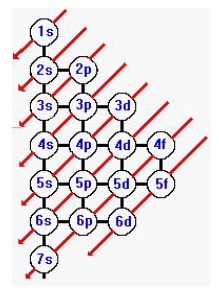
Os subníveis são preenchidos em ordem crescente de energia (ordem energética). Linus Pauling descobriu que a energia dos subníveis cresce na ordem:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…. Para obter essa ordem basta seguir as diagonais no Diagrama de Pauling abaixo:
Diagrama de Linus Pauling
Vamos ver o exemplo do oxigênio:
Oxigênio (O) Z = 8 → 1s2 2s2 2p4 (estado fundamental).
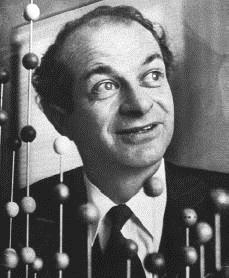 Linnus Carl Pauling (1901-1994) foi um químico quântico e bioquímico dos Estados Unidos.
Linnus Carl Pauling (1901-1994) foi um químico quântico e bioquímico dos Estados Unidos.
Foi pioneiro na aplicação da Mecânica Quântica em química e, em 1994, ganhou o Nobel de Química pelo seu trabalho relativo à natureza das ligações químicas. Pauling recebeu o Nobel da Paz de 1962, pela sua campanha contra os testes nucleares e é a única personalidade a ter recebido dois Prêmios Nobel não compartilhados.
Vamos aprender mais um pouco? Não desista agora!! Assista este outro vídeo da Khan Academy sobre os orbitais, e mande super bem nas questões sobre elétrons nas provas dos vestibulares ou do Enem.
Os textos e exemplos de apresentação desta aula foram preparados pela professora Munique Dias para o Blog do Enem. Munique é formada em química pela UFSC, tem mestrado e doutotorado em Engenharia Química, também pela UFSC. Facebook: https://www.facebook.com/MuniqueDias .
Munique é formada em química pela UFSC, tem mestrado e doutotorado em Engenharia Química, também pela UFSC. Facebook: https://www.facebook.com/MuniqueDias .