A variação de energia interna (ΔU) equivale à diferença entre o calor (Q) trocado pelo sistema com o meio externo e o trabalho (τ) realizado por ele. Você lembra? - É hora de revisar as Leis da Termodinâmica para o Enem e os vestibulares.
Para iniciar os estudos sobre a termodinâmica, ramo responsável pelo estudo das relações entre as mudanças de temperatura, pressão e volume, é preciso definir alguns conceitos importantes como calor, energia e energia interna.
- Vamos rever esses conceitos:
- Calor (Q) é a energia térmica em transição. Isso acontece entre corpos ou sistemas com diferença de temperatura, em busca de um equilíbrio térmico.
- Energia é a capacidade que um corpo possui de realizar trabalho.
- Energia interna (U) de um sistema é a soma de todas as energias das partículas que compõem um gás.
Agora que já tomamos conhecimento de alguns conceitos importantes, vamos começar o nosso estudo sobre as duas Leis da Termodinâmica?
A Primeira Lei da Termodinâmica diz que a variação de energia interna (ΔU) equivale à diferença entre o calor (Q) trocado pelo sistema com o meio externo e o trabalho (τ) realizado por ele, ou seja:
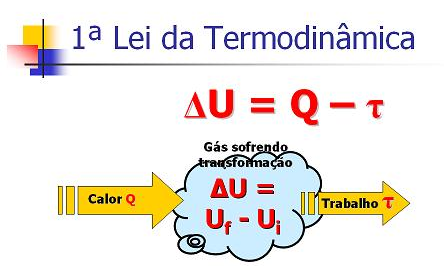
As transformações estudadas por essa lei são:
1- Transformação isobárica: ocorre sob pressão constante, podendo alterar temperatura e volume.
2- Transformação isotérmica: ocorre sob temperatura constante, podendo alterar pressão e volume.
3- Transformação isocórica ou isovolumétrica: ocorre sob volume constante, podendo variar pressão e temperatura.
4- Transformação adiabática: ocorre quando a troca de calor com o meio externo (Q) é nula, seja porque ele está termicamente isolado ou porque o processo ocorre de forma tão rápida que o calor trocado é desprezível.
Dica 1 – Quer saber o que mais pode encontrar no Enem? Confira o que mais cai física no Enem!
Aula Gratuita sobre a 1ª Lei da Termodinâmica
Assista ao vídeo do professor de Física Márcio Rosseto, no nosso canal Curso Enem Gratuito, para fixar ainda mais os conhecimentos sobre essa lei, assunto tão frequente nas provas do Enem e nos vestibulares! Vale a pena conferir!
Veja agora a 2ª Lei da Termodinâmica
A Segunda Lei da Termodinâmica, enunciada pelo físico francês Sadi Carnot, afirma que é impossível que uma máquina térmica cíclica converta integralmente calor em trabalho, ou seja, o rendimento (η) de uma máquina nunca será 100%. É o famoso Princípio de Carnot.
Nicolas Léonard Sadi Carnot (1796-1832) é um nome importante na história da Termodinâmica, por ter introduzido a idéia de transformações cíclicas e por ter provado que a mais eficiente das máquinas termodinâmicas é aquela em que todas as operações são reversíveis.
Carnot diz:
‘’Para que um sistema realize conversões de calor em trabalho, ele deve realizar ciclos entre uma fonte quente e fria, isso de forma contínua. A cada ciclo é retirada uma quantidade de calor da fonte quente, que é parcialmente convertida em trabalho e a quantidade de calor restante é rejeitada para a fonte fria. ’’
Dica 2: Veja também outro assunto de Física bastante cobrado no Enem e nos vestibulares: As três Leis de Newton. Não deixe essa chance passar.
Exercícios sobre as Leis da Termodinâmica
Observe alguns exemplos do que pode ser cobrado nas provas do Enem e nos vestibulares abordando a termodinâmica:
Questão 1)(UFVJM/2007) Tendo-se uma amostra de gás ideal em expansão isotérmica, é CORRETO afirmar que:
A) o trabalho realizado pelo gás é igual à variação de sua energia interna.
B) o trabalho realizado pelo gás é igual ao calor absorvido pelo mesmo.
C) o calor absorvido pelo gás é nulo.
D) a energia cinética média das moléculas do gás aumenta.
Resolução: Quando um gás ideal sofre expansão isotérmica significa que a sua temperatura não varia, ou seja, a variação de energia interna (ΔU) é nula. Colocando na equação, tem-se:
ΔU = Q – τ
0 = Q – τ
Q = τ
Gabarito: B.


