Veja as trocas de energia nas reações químicas. Relembre Medidas de Calor, Entalpia e Equação Termoquímica nesta aula de Química para o Enem e os vestibulares.
É hora de rever Calor, Entalpia, e as Equações Termoquímicas. Quem acerta uma questão destas fica na frente no Enem ou no Vestibular. Vale muito aprender os conceitos, e aprender a fazer as equações. Vamos?
Termoquímica é a parte da termodinâmica que estuda as quantidades de calor liberadas ou absorvidas durante as reações químicas. Em toda reação química há uma troca de energia. Essa energia se manifesta de diversas maneiras, seja pela emissão ou absorção de luz, de calor, de eletricidade, ou mesmo pela mudança de estado físico dos participantes da reação. Podemos conceituar a energia como a capacidade de realizar trabalho. Então quando algo se movimenta, um carro, uma pessoa por vontade própria quer dizer que está utilizando alguma forma de energia.
Podemos conceituar a energia como a capacidade de realizar trabalho. Então quando algo se movimenta, um carro, uma pessoa por vontade própria quer dizer que está utilizando alguma forma de energia.
Um carro por exemplo entra em movimento devido a energia liberada pelo álcool, que provém da cana que absorveu a energia do sol.
A cana armazena a energia solar em suas ligações químicas entre o Oxigênio, Carbono e Hidrogênio que forma a molécula da álcool (METANOL), numa reação violenta com Oxigêncio (combustão), daí é liberada a água, dióxido de carbono e calor (energia) que fará o movimento do carro. Veja um gráfico clássico de reação com liberação de energia: 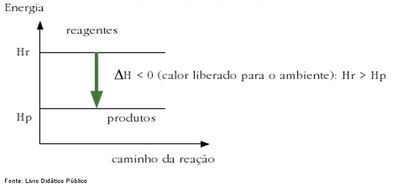 Este é um bom exemplo de reação exotérmica, pois libera calor ao ocorrer. Neste caso, uma parte do calor resulta ao final no movimento realizado.
Este é um bom exemplo de reação exotérmica, pois libera calor ao ocorrer. Neste caso, uma parte do calor resulta ao final no movimento realizado.
Entalpia (H)
É o conteúdo global de energia (calor) num sistema. Podemos medir a quantidade de calor presente em um sistema, mas podemos medir também a variação de calor que ocorre no mesmo representando da seguinte forma: Variação de entalpia = valor final – valor inicial
Quer entender melhor o que é entalpia? Veja a videoaula do Curso Enem Gratuito com o prof. Sobis!
A Equação Termoquímica
Ao representarmos uma equação química e o calor nela envolvido, o fizemos como se esse calor fosse um dos reagentes ou um dos produtos da reação. Entretanto, essa não é a forma absolutamente correta de fazer esta representação.
A equação termoquímica é a forma correta de representar a reação química e o calor nela envolvido. Essa equação deve conter todas as informações referentes à reação e às condições que a mesma ocorre: temperatura e pressão, estados físicos dos participantes e variação de entalpia.
Temperatura e pressão em que ocorre a reação: 25º C, 1 atm indica que a reação ocorre nas condições ambientais; 0º C, 1 atm indica que a reação ocorre nas condições normais. Não havendo indicação de temperatura e pressão, subentendemos que a reação ocorre nas condições ambientais.
A Variação de Entalpia
ΔH = Hf – Hi
Onde:
- ΔH = variação de entalpia
- Hf = entalpia final (produto)
- Hi = entalpia inicial (reagentes)
Dica do Blog: Veja o que mais cai de Química no Enem 
Os professores do Curso Enem Gratuito prepararam aulas sobre os 10 Temas que mais caem de Química no Enem e nos Vestibulares. Confira, para você mandar bem: Fontes de Energia; Cálculo de pH e de pOH; Estados de Oxidação e Redução; Cálculo Estequiométrico; Hidrocarbonetos; Aquecimento Global; Equilíbrio Químico; Cálculo do NOX – Número de Oxidação; Balanceamento Químico; Introdução à Química Orgânica;
As Medidas de Calor
|
Caloria (cal) |
Unidade térmica britânica (BTU) |
Joule (J) |
|
Quantidade de calor necessária para elevar de 1ºC a temperatura de 1g de água, 14,5ºC a 15,5ºC |
Quantidade de calor necessária para elevar de 1ºF a temperatura de 1libra (453,6g) de água |
Trabalho realizado pela força de 1 newton (1N) que, aplicada a um corpo, desloca-o na sua direção pela distância de 1 m |
|
1000 cal = 1kcal (quilocaloria) 106 = 1 Th (thermia) |
1 BTU = 252 cal |
1J = 0,239 cal 1 cal = 4,184J |
A Classificação das reações químicas
- Reações Exotérmicas: É a reação que para ocorrer libera calor (exo = para fora)
Ex: a reação de formação da molécula da água.
H2(g) + ½O2(g) → H2O(L)
(g) = estado gasoso
(L) = estado líquido
H2(g) + ½O(g) → H2O(L) – 68,3 Kcal
- O sinal positivo indicará a ocorrência de uma reação exotérmica, apesar de perder calor o sinal que representará será o (+) e o contrário com uma reação endotérmica que receberá o sinal (-).
- Reações Endotérmicas: É a reação que para ocorrer é necessário que absorva calor (endo = para dentro)
Ex: síntese do óxido de nitrogênio.
N2(g) + O2(g) → 2NO(g) + 43 Kcal
Fatores que influenciam o ΔH numa reação química
- Estado padrão:
- Temperatura: 25ºC ou 298 K
- Pressão: 1 atm
- Estado alotrópico (estado mais estável)
- Estado Físico:
- H2(g) + ½O2(g) → H2O(s) ΔH = -70,0 Kcal
- H2(g) + ½O2(g) → H2O(L) ΔH = -68 Kcal
- H2(g) + ½O2(g) → H2O(g) ΔH = -57,8 Kcal
- Estado alotrópico: É o fenômeno de ocorrência de diferentes substâncias simples constituídas por átomos de mesmo elemento químico.
Ex: Oxigênio comum (O2) e ozônio (O3);
Fósforo branco ( P4) e fósforo vermelho (Pn);
Carbono diamante (Cn) e carbono grafite ( C3).
- A forma alotrópica de menor entalpia é a mais estável e abundante na natureza. A essa forma mais estável é atribuída a entalpia zero.
- Quantidade de reagentes e produtos: A quantidade de calor envolvida em uma reação química é proporcional á quantidade de produtos e reagentes que participam da reação.
Ex: H2(g) + ½O2(g) → H2O(s) – 70 Kcal
2H2(g) + O2(g) → 2H2O(s) – 140 Kcal
- Presença de Solvente: Quando há presença de solvente, consequentemente há alteração na liberação ou absorção de calor.
Ex: H2(g) + Cl(g) → 2HCl(g) + 44,2 Kcal
H2(g) + Cl(g) → 2HCl(aq) + 80,2 Kcal
Tipos de calores de reação
- Calor de fusão: É a variação de entalpia observada (calor absorvido) na fusão total de 1 mol da substância, a pressão de 1 atm:
H2O(s) → H2O(L) ΔH = +1,7 Kcal/mol (calor de fusão da água sólida)
- Calor de Solidificação: É a variação de entalpia observada (calor liberado) na solidificação total e 1 mol da substância, à pressão de 1 atm:
H2O(L) → H2O(s) ΔH = -1,7 Kcal/mol (calor de solidificação da água líquida)
- Calor de Solução ou Calor de Dissolução: É a variação de entalpia observada na dissolução de 1 mol da substância (soluto) em solvente para uma solução diluída, de modo que a adição de mais solvente não altere o estado térmico do sistema.
- Calor de dissolução do gás clorídrico:
HCl(g) + H2O(l) → H3O+(aq) + Cl–(aq) ΔH = -18 Kcal/mol
- note que a dissolução do HCl(g) é um processo exotérmico
- Calor de Neutralização: É a variação de entalpia observada na neutralização de 1mol de H+(aq) com 1 mol de OH-(aq), ambos em soluções diluídas.
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(L) ΔH = -13,8 Kcal/mol
HNO3(aq) + KOH(aq) → KNO3(aq) + H2O ΔH = -13,8 Kcal/mol
- Quando a neutralização ocorre entre um ácido e uma base fortes, o calor de neutralização sempre será constante, pois a única reação que ocorre é a seguinte.
H+(aq) + OH–(aq) → H2O(L) ΔH = -13,8 Kcal/mol
- Se o ácido ou base, ou ambos forem fracos, o calor de neutralização é diferente em cada caso. Essa diferença se dá em virtude de ocorrerem outras reações simultaneamente à neutralização (hidrólise, hidratação, etc.), cujos ΔH, somados ao calor de neutralização, dão no balanço energético final um valor diferente de 13,8 kcal/mol:
HCN(aq) + NaOH(aq) → NaCN(aq) + H2O(L) ΔH = -25 kcal/mol
- Calor de Formação (ΔHof): É a variação de entalpia observada na formação de 1 mol de moléculas de um composto, a partir dos elementos em seu estado padrão.
- Um mol de uma substância simples;
- Condições ambientes de 25 oC e 1 atm;
- Estado físico habitual, nas condições ambientes;
- Estado alotrópico mais estável.
- Calor de combustão: É a variação de entalpia observada na combustão de 1 mol da substância, nas condições ambientes. As substâncias devem estar no seu estado físico habitual.
Combustão é a reação entre o combustível e o comburente, liberando calor.
- Combustível: pode ser qualquer substância;
- Comburente: o principal deles é o O2(g).
Ex: Combustão do metano:
1CH4(g) + 2O2(g) → CO2(g) + 2H2O(L) ΔH = -212,8 kcal/mol
O calor de combustão do metano é de 212,8 kcal/mol, pois esse valor corresponde à combustão de 1 mol de CH4(g).
Dica 1 – Você sabia que as soluções podem ser líquidas, sólidas e gasosas? Revise tudo sobre o Coeficiente de Solubilidade em mais uma aula de Química Enem – https://blogdoenem.com.br/coeficiente-de-solutilidade-quimica-enem/
Dica 2 – Preparado para o Exame Nacional do Ensino Médio? Relembre sobre as classificações das reações químicas e balanceamento de equações com esta de Química Enem – https://blogdoenem.com.br/reacoes-inorganicas-quimica-enem/
Desafios para você resolver e compartilhar a resolução
Questão 01 – Termoquímica
Em qual das condições abaixo a água apresenta a maior entalpia?
a) Gelo a 0 oC;
b) Água líquida a 0 oC;
c) Água líquida a 30 oC;
d) Água líquida a 100 oC;
e) Vapor d’água a 110 oC.
Questão 02
Derramando-se acetona na mão, tem-se uma sensação de frio, porque:
a) a acetona reage exotermicamente com a pele;
b) a evaporação da acetona é um processo endotérmico;
c) a evaporação da acetona é um processo exotérmico;
d) a acetona foi previamente aquecida;
e) a acetona fornece calor à pele para evaporar;
Dica 3 – Entenda como identificar o Grau de Pureza dos Reagentes e o Rendimento da Reação nesta aula de Química Enem – https://blogdoenem.com.br/calculo-estequiometrico-quimica-enem/
Questão 03
Cerca de 80% da energia consumida no mundo deriva da queima de petróleo, carvão ou gás natural, que são fontes energéticas não-renováveis e irão se esgotar a médio ou longo prazo.
Uma das alternativas, para resolver o problema, é o uso da biomassa, matéria orgânica que, quando fermenta, produz o biogás, cujo principal componente é o metano.
A queima do metano se dá pela equação
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ∆H = -888 kJ/mol
Em relação a essa equação, analise as afirmativas a seguir e assinale verdadeira (V) ou falsa (F) em cada uma delas.
( ) A reação de combustão do metano é exotérmica.
( ) A entalpia dos reagentes é menor que a entalpia dos produtos.
( ) A variação de entalpia, nesse caso, indica que a quantidade de calor absorvida é de 888 kJ/mol.
A seqüência correta é
a) V – F – F.
b) V – F – V.
c) F – V – F.
d) F – V – V.
e) V – V – F.
Questão 04
Em uma cozinha, estão ocorrendo os seguintes processos:
I. gás queimando em uma das “bocas” do fogão e
II. água fervendo em uma panela que se encontra sobre esta “boca” do fogão.
Com relação a esses processos, pode-se afirmar que:
a) I e II são exotérmicos.
b) I é exotérmico e II é endotérmico.
c) I é endotérmico e II é exotérmico.
d) I é isotérmico e II é exotérmico.
e) I é endotérmico e II é isotérmico.
Questão 05
Observando o diagrama a seguir, é correto afirmar que:
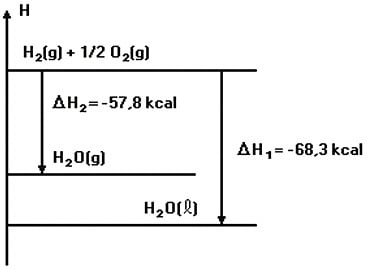
[Dadas as massas molares (g/mol): H=1 e O=16]
a) para vaporizar 18g de água são liberados 10,5 kcal.
b) o calor de reação, na síntese da água líqüida, é igual ao da água gasosa.
c) a entalpia para vaporizar um mol de água é +10,5 kcal.
d) a síntese da água gasosa libera mais calor que a da água líqüida.
e) o ∆H na síntese de água gasosa é igual a -126,1kcal/mol.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!


